-
カテゴリ別
-
場所
-
最新のお知らせ 年間スケジュール(就職対策講座等) OB・OG情報 システムの利用方法 学内合同企業説明会 その他の企業説明会 公務員・教員等採用情報 就職相談 就職情報室 キャリア教育 低年次学年向け情報 インターンシップ TOEIC対策プログラム 博士人材のための就職支援 外国人留学生のための就職支援 未内定の学生及び既卒者(卒業後3年以内)の皆様へ 障害のある学生のための就職支援 部局独自の就職支援 東京・大阪・博多駅オフィスの利用 各種情報サイト 過去の就職状況 採用選考に関する指針 学内合同企業説明会 学内個別企業説明会 博士人材のための企業説明会 本学へのご訪問 求人情報ご提供 OB・OG名簿ご提供 インターンシップ 外国人留学生の採用 採用選考に関する指針 就職担当
-
人工抗体・酵素の実現を目指して・星野友教授 医療の未来を紡ぐ100年のカイコ研究・日下部宜宏教授 生体親和性の科学を解き明かす・田中賢教授 ロボットの明日を描く・倉爪亮教授 生命のリレーを探索する・林克彦教授 新材料を開拓し、次世代エネルギーの実現へ・山崎仁丈教授 水素エネルギーが未来を照らす・林灯教授 サプライチェーンの脱炭素化が急務・加河茂美主幹教授 数の美しい関係を数学で見つけ出す・金子昌信教授 建設作業の合理化で安全な建物を・松尾真太朗准教授 気候変動に役立つ高分子膜の開発を・谷口育雄准教授 磁場から地球と太陽系の起源に迫る・高橋太准教授 安全な宇宙空間を次世代に・花田俊也教授 口の細菌バランスで体の健康を守る・山下喜久教授 社会の復興に芸術で貢献・知足美加子教授 深刻化するマイクロプラスチックの海洋汚染問題に挑む・磯辺篤彦教授
Research Results 研究成果
肝細胞へのダイレクトリプログラミングを誘導する分子メカニズムの解明
転写因子の新規作用機序の発見 2020.08.05研究成果Life & Health
九州大学生体防御医学研究所の鈴木淳史教授、堀澤健一助教らの研究グループは、同研究所の大川恭行教授、京都大学の長﨑正朗教授、国立国際医療研究センターの植野和子研究員との共同研究により、線維芽細胞から肝細胞への直接的な運命転換(ダイレクトリプログラミング)を制御する分子メカニズムの解明に成功しました。
鈴木教授らは、2011年にマウスの皮膚から抽出した線維芽細胞に2つの転写因子※1(Hnf4αとFoxa1、2、3のいずれか1つ)を導入することで、線維芽細胞を肝細胞の性質を有する「iHep細胞」へと変化させることに成功しました(Sekiya and Suzuki, Nature, 2011)。本研究では、iHep細胞誘導因子である2つの転写因子の挙動を詳しく解析するとともに、線維芽細胞が肝細胞の運命を獲得する過程で生じる遺伝子発現変化やクロマチン※2状態変化、エピゲノム状態変化などを統合的に解析し、転写因子のDNAへの結合から始まる一連のダイナミックな細胞状態変化の全容を解明することができました。興味深いことに、iHep細胞誘導因子の1つであるFoxa3が、同じファミリーに属するFoxa1やFoxa2とは異なる様式で標的遺伝子の発現を誘導することが判明しました。本研究において、Foxa3がFoxa1やFoxa2と同じパイオニア因子※3としてクロマチン構造を開くことが明らかになりましたが、Foxa3はその後速やかに転写開始点付近に転位してRNAポリメラーゼⅡ※4と結合し、一緒にDNA上を動くことで標的遺伝子の転写を活性化することがわかりました。この特徴的なFoxa3の作用機序は、Hnf4αとFoxa3を用いたiHep細胞誘導に必要不可欠であることも判明しました。RNAポリメラーゼⅡと転写因子の機能的な結合はFoxa3以外の転写因子でも起こりうることから、細胞運命制御に関連する他の転写因子にも同様の働きが今後明らかになるかもしれません。本研究で明らかとなったiHep細胞の誘導メカニズムは、iHep細胞の質の向上や安全性の担保など、iHep細胞の医療応用において重要な知見になるだけでなく、肝細胞の分化機序やその破綻による病気の発症機構の解明にもつながると考えられます。
本研究成果は、2020年8月5日(水)午前0時(日本時間)に米国科学雑誌『Molecular Cell』 オンライン版に掲載されました。
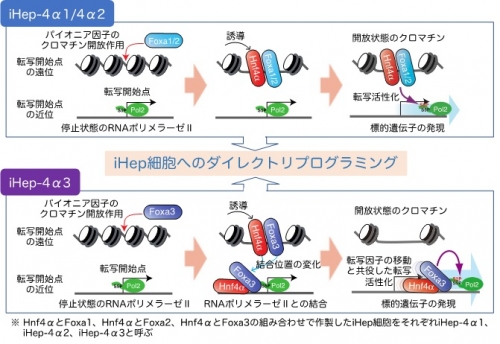
(参考図)
研究者からひとこと
わずか2つの転写因子が如何にして細胞の運命を急速かつ急激に変化させるのか、本研究ではその大枠を解明することができました。研究の立案から9年という長い時間を要しましたが、我々が見つけたiHep細胞に何が起きているのかを多面的に解析し、それらを統合し理解するためには必要な時間だったと思います。「ダイレクトリプログラミング」という事象にはまだまだ多くの謎が隠されていますので、今後も研究を進め、iHep細胞の医療応用や肝臓学の発展に貢献したいと考えています。
- 本研究についての詳細は こちら
論文情報
The dynamics of transcriptional activation by hepatic reprogramming factors ,Molecular Cell, 2020.,DOI: 10.1016/j.molcel.2020.07.012