-
カテゴリ別
-
場所
-
最新のお知らせ 年間スケジュール(就職対策講座等) OB・OG情報 システムの利用方法 学内合同企業説明会(「九州大学生のための業界・企業研究」) 学内企業研究セミナー / 個別企業説明会 公務員・教員等採用情報 就職相談 就職情報室 キャリア教育 低年次学年向け情報 インターンシップ等(学生向け) TOEIC対策プログラム 博士人材のための就職支援(学生向け) 外国人留学生のための就職支援 未内定の学生及び既卒者(卒業後3年以内)の皆様へ 障害のある学生のための就職支援 部局独自の就職支援 東京・大阪・博多駅オフィスの利用 各種情報サイト 過去の就職状況 採用選考に関する指針 学内合同企業説明会 博士人材のための企業説明会(企業向け) 本学へのご訪問 求人情報ご提供 OB・OG名簿ご提供 インターンシップ等(企業向け) 外国人留学生の採用 採用選考に関する指針 就職担当 よくあるご質問
Research Results 研究成果
エキソ-β-D-グルコサミニダーゼの基質認識機構と分子進化を解明ーグルコサミンの高生産化に寄与することが期待されるー
2017.03.30研究成果Life & HealthPhysics & Chemistry
九州大学大学院薬学研究院の阿部義人准教授、植田正教授、産業技術総合研究所生命工学領域バイオメディカル研究部門の峯昇平博士らの共同研究グループは、軟骨の成分で知られているグルコサミンを生成するエキソ-β-D-グルコサミニダーゼ (GlmA)の立体構造を明らかにし、これまでアミノ酸配列情報からだけでは不明であった活性部位を特定し、GlmAがなぜグルコサミンを生成できるのかを明らかにしました。また、GlmAの立体構造が別酵素であるガラクトシダーゼに似ていることを示した為、これらのガラクトシダーゼが古細菌由来のGlmAから分子進化した可能性がある事が分かりました。
好熱性古細菌由来のGlmAは、キチナーゼやデアセチラーゼと共にバイオマス資源であるキチン(エビやカニの甲羅の構成成分)をグルコサミンまでに分解する糖質分解酵素群の1つであり、100℃でも安定な酵素です。最終生成物のグルコサミンは食品添加物、医薬品に利用されており、その産業応用が期待されています。これらの結果から、酵素機能変換によりキチン分解反応の効率を高め、今後のグルコサミンの高生産化に寄与することが期待されます。
本研究成果は、3月24日(金)に米国の国際学術誌『The Journal of Biological Chemistry』に掲載されました。
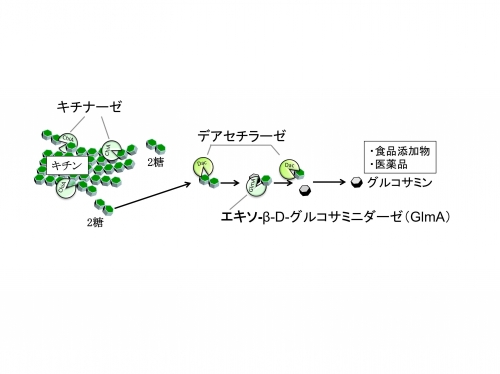
好熱性古細菌のキチン代謝経路
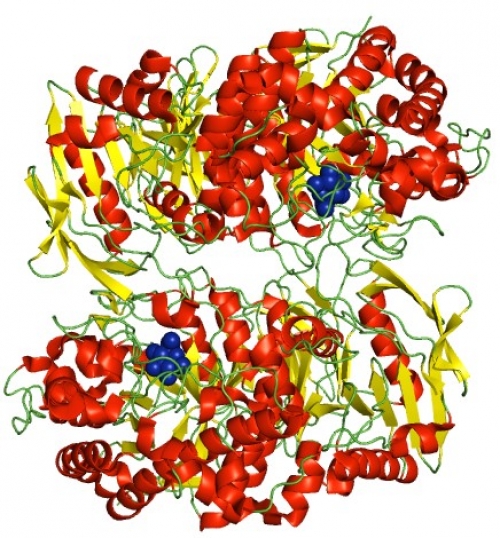
Thermococcus Kodakarensis由来のエキソ-β-D-グルコサミニダーゼ (GlmA)と基質グルコサミン(青)との複合体の結晶構造(PDBID:5GSM)
研究者からひとこと
酵素の立体構造を解くことで、活性部位、基質の配置、分子進化などの情報が得られます。また、この立体構造を元に、医薬品原料等の創生に有益な酵素のデザインにつながる可能性もあります。
- 本研究についての詳細は こちら
論文情報
The Structure of an Archaeal β-Glucosaminidase Provides Insight into Glycoside Hydrolase Evolution ,The Journal of Biological Chemistry,10.1074/jbc.M116.766535