-
カテゴリ別
-
場所
-
最新のお知らせ 年間スケジュール(就職対策講座等) OB・OG情報 システムの利用方法 学内合同企業説明会(「九州大学生のための業界・企業研究」) 学内企業研究セミナー / 個別企業説明会 公務員・教員等採用情報 就職相談 就職情報室 キャリア教育 低年次学年向け情報 インターンシップ等(学生向け) TOEIC対策プログラム 博士人材のための就職支援(学生向け) 外国人留学生のための就職支援 未内定の学生及び既卒者(卒業後3年以内)の皆様へ 障害のある学生のための就職支援 部局独自の就職支援 東京・大阪・博多駅オフィスの利用 各種情報サイト 過去の就職状況 採用選考に関する指針 学内合同企業説明会 博士人材のための企業説明会(企業向け) 本学へのご訪問 求人情報ご提供 OB・OG名簿ご提供 インターンシップ等(企業向け) 外国人留学生の採用 採用選考に関する指針 就職担当 よくあるご質問
Research Results 研究成果
敗血症をより増悪させるミトコンドリア依存的なメカニズムを解明―敗血症治療薬の開発へ新たな道筋―
2017.06.20研究成果Life & Health
九州大学大学院医学研究院臨床検査医学分野の康東天教授、後藤和人助教と佐々木勝彦氏(民間等共同研究員、株式会社LSIメディエンス)らの研究グループは、国立大学法人九州大学と株式会社LSIメディエンスの組織対応型連携の枠組みでの共同研究により、大腸菌の壁構成成分の一つであるリポ多糖(LPS)により免疫細胞から産生される炎症性サイトカインの一つであるインターロイキン6の量がミトコンドリアの特定の機能により調節されていることを明らかにしました。さらに、マウスの敗血症モデルを用いて、独自に作成したp32部分欠損マウスにおいて生存率が低下することを見出しました。
敗血症は世界で1800万人が罹患し、医療の進んだ先進国においても死亡率が30%程度と推定されるため、さらなる治療法の開発が必要とされています。これまでの研究において、敗血症予後は、ミトコンドリアの機能や血中のインターロイキン6の量に相関することが示されていました。研究グループは、ミトコンドリア機能を阻害する薬剤をスクリーニングして、ミトコンドリアタンパク質を合成する機能が大腸菌由来のLPSに対するインターロイキン6の産生に影響を与えていることを見出しました。さらにミトコンドリアタンパク質の合成を制御する分子の一つであるp32という遺伝子の部分欠失マウスを樹立しました。敗血症モデルではこのp32という遺伝子がインターロイキン6の量と予後に影響を与えていることを見出しました。さらに、線維芽細胞やマクロファージなど細胞を用いて、過剰に産生されるインターロイキン6はATF4という分子が核に移行することより起こるメカニズムを明らかにしました。以上の結果を踏まえると、ミトコンドリアの特定の機能を保護することやATF4という分子を阻害することが重症な敗血症の新たな治療のターゲットになると期待されます。
本研究の成果は、Cell誌とLancet誌が共同でサポートする新規オープンアクセス誌EBioMedicineに2017年5月11日(米国時間)公開されました。
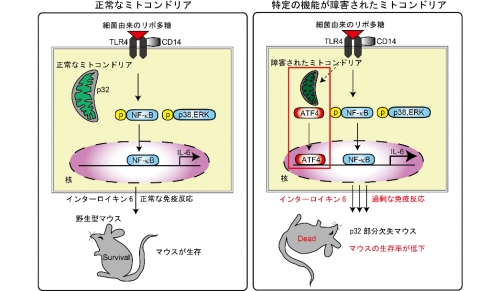
図1. 正常なミトコンドリア機能である場合には、細菌由来のリポ多糖に対して炎症性サイトカインであるインターロイキン6が適切に産生されて免疫応答を行う。
しかしながら、特定のミトコンドリア機能が障害された場合には、ATF4という分子が活性化しインターロイキン6が過剰に産生され、敗血症モデルのマウス個体の生存率が低下する。
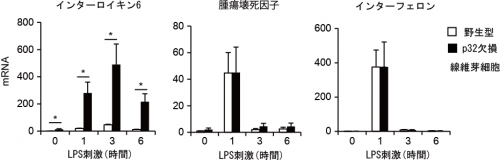
図2.大腸菌由来のLPSで刺激すると、p32遺伝子欠損によりインターロイキン6のみが過剰に増加する。腫瘍壊死因子やインターフェロンの量はp32の遺伝子欠損の影響を受けない。
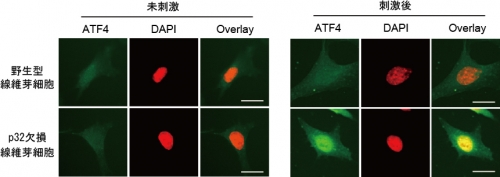
図3.大腸菌由来のLPSで刺激すると、p32遺伝子欠損線維芽細胞はATF4が核に集積する。
野生型線維芽細胞ではATF4は核に移行しない。
研究者からひとこと
世界中の多くの患者が敗血症により命を落としています。本研究をさらに前に推し進めて、その結果、新たな臨床検査法・創薬の開発などへとつなげて行きたいと思います。
- 本研究についての詳細は こちら
論文情報
p32 is Required for Appropriate Interleukin-6 Production Upon LPS Stimulation and Protects Mice from Endotoxin Shock ,Ebiomedicine,http://dx.doi.org/10.1016/j.ebiom.2017.05.018