-
カテゴリ別
-
場所
-
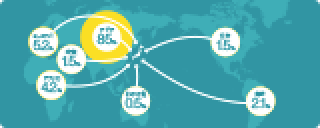
最新のお知らせ 年間スケジュール(就職対策講座等) OB・OG情報 システムの利用方法 学内合同企業説明会(「九州大学生のための業界・企業研究」) 学内企業研究セミナー / 個別企業説明会 公務員・教員等採用情報 就職相談 就職情報室 キャリア教育 低年次学年向け情報 インターンシップ TOEIC対策プログラム 博士人材のための就職支援 外国人留学生のための就職支援 未内定の学生及び既卒者(卒業後3年以内)の皆様へ 障害のある学生のための就職支援 部局独自の就職支援 東京・大阪・博多駅オフィスの利用 各種情報サイト 過去の就職状況 採用選考に関する指針 学内合同企業説明会 博士人材のための企業説明会 本学へのご訪問 求人情報ご提供 OB・OG名簿ご提供 インターンシップ 外国人留学生の採用 採用選考に関する指針 就職担当 よくあるご質問
Research Results 研究成果
環境化学物質によるタンパク質脱イオウ化が心不全リスク増大の原因に! -心不全の新たな予防・治療薬の開発に期待-
2019.06.26研究成果Life & Health
心不全は予後不良の病気である。今回、九州大学大学院薬学研究院の西田基宏教授(自然科学研究機構生理学研究所(生命創成探究センター)兼任)と西村明幸講師は、筑波大学、東北大学、国立医薬品食品衛生研究所との共同研究により、環境化学物質の一つであるメチル水銀(MeHg)の低濃度曝露が心不全の病態を悪化させる分子機構を明らかにしました。MeHgはミトコンドリア分裂促進タンパク質Drp1のポリイオウ鎖)と化学反応し、イオウを引き抜く(脱イオウ化)ことでミトコンドリアの過剰分裂を引き起こし、圧負荷で誘発される心不全の病態を悪化させること、イオウドナー)を投与しDrp1ポリイオウ鎖を保護することで心不全増悪が解除されることが、マウスを用いた実験から明らかになりました。本研究成果は、タンパク質ポリイオウ量が環境化学物質による疾患発症リスクを規定する重要な指標となることを示すとともに、新たな心不全の予防・治療法の開発にも大きく貢献することが期待されます。本研究成果はScience Signaling電子版に掲載されました。
図1:MeHg曝露マウスは圧負荷刺激に対して脆弱になる。(A, B)神経毒性を示さない微量メチル水銀(10 ppm)を含む水を1週間与えたマウスに大動脈狭窄による圧負荷処置を施し、その後の体重変化(A)と生存率(B)を4週間測定した。(C)圧負荷誘発後1週間における左室内径短縮率(心機能の指標)を測定した。
図2:MeHg曝露心筋細胞のストレス脆弱性とシルニジピンによる抑制効果。(A)我々が昨年度明らかにしたミトコンドリア異常分裂を介した心筋早期老化機構。ミトコンドリア分裂促進因子Drp1がアクチン結合蛋白質filaminと複合体を形成することでミトコンドリア分裂が促進される。このミトコンドリア異常分裂が心筋早期老化の引き金となる。既承認薬シルニジピンはDrp1-filamin複合体形成を阻害することでミトコンドリア異常分裂を抑制する。(B)MeHg曝露心筋細胞の浸透圧刺激脆弱性。
図3:本研究内容の概略図。MeHgなど親電子性の高い環境化学物質はタンパク質システイン残基に形成されるポリイオウ鎖からイオウを引き抜くことでタンパク質(Drp1など)の機能を修飾する。これがミトコンドリア品質異常を伴う心臓のストレス抵抗性減弱の原因となる。生体外からイオウを供給しポリイオウ鎖を保護することで心疾患リスクが軽減される。
- 本研究についての詳細は こちら
論文情報
Depolysulfidation of Drp1 induced by low-dose methylmercury exposure increases cardiac vulnerability to hemodynamic overload ,Science Signaling,10.1126/scisignal.aaw1920