-
カテゴリ別
-
場所
-
最新のお知らせ 年間スケジュール(就職対策講座等) OB・OG情報 システムの利用方法 学内合同企業説明会(「九州大学生のための業界・企業研究」) 学内企業研究セミナー / 個別企業説明会 公務員・教員等採用情報 就職相談 就職情報室 キャリア教育 低年次学年向け情報 インターンシップ等(学生向け) TOEIC対策プログラム 博士人材のための就職支援(学生向け) 外国人留学生のための就職支援 未内定の学生及び既卒者(卒業後3年以内)の皆様へ 障害のある学生のための就職支援 部局独自の就職支援 東京・大阪・博多駅オフィスの利用 各種情報サイト 過去の就職状況 採用選考に関する指針 学内合同企業説明会 博士人材のための企業説明会(企業向け) 本学へのご訪問 求人情報ご提供 OB・OG名簿ご提供 インターンシップ等(企業向け) 外国人留学生の採用 採用選考に関する指針 就職担当 よくあるご質問
Research Results 研究成果
多発性硬化症の新たな病態メカニズムを解明~ギャップ結合蛋白が中枢グリア炎症を制御~
2020.01.28研究成果Life & Health
九州大学大学院医学研究院の吉良潤一教授、山﨑亮准教授、山口浩雄共同研究員、大学院医学府博士課程4年の趙奕楠、博士課程1年の永田諭らの研究グループは、二次進行形多発性硬化症の新たな病態メカニズムとして、脳・脊髄のグリア細胞同士をつなぐギャップ結合蛋白がグリア炎症を制御しており、これらの機能異常が多発性硬化症の進行に大きく関わっていることを発見しました。
多発性硬化症は、国指定の難病で、原因は解明されておらず根治療法はありません。近年、増加が著しく、我が国で約2万5千人、世界では250万人以上の患者さんがいます。自己免疫機序により脳や脊髄、視神経といった中枢神経の神経突起を絶縁するビニールのように取り巻いている髄鞘が繰り返し障害され、感覚低下や運動麻痺、視力障害、言語障害、歩行障害、排尿・排便障害などの様々な神経症状を引き起こします。この病気は1:3の割合で女性に多く、20歳代から30歳代の若年成人が侵されやすく、いったん発病すると終生罹患するため、大きな社会問題となっています。
多発性硬化症は、発症初期は症状が自然に良くなります(「再発寛解型」という。)が、発症10年後ごろから症状が治らなくなり、やがて再発していないのに症状が次第に進行する「二次進行型」に移行します。現在、再発寛解型の再発を減らす薬は保険診療で使用できますが、二次進行形に移行すると、そのメカニズムがよくわかっていないため有効な治療薬が開発されていませんでした。
今回、研究グループは、多発硬化症のモデルマウスで中枢神経の髄鞘を産生するオリゴデンドログリアのギャップ結合蛋白コネキシン47を特異的に喪失させると、中枢神経のグリア細胞が異常に活性化して、末梢血から自己免疫細胞を呼び込み、髄鞘が破壊されることで、二次進行型と同様の症状と経過を示すことを世界で初めて発見しました。マウスでみられたグリア細胞の活性化やコネキシン蛋白の発現変動はこれまでも多発性硬化症患者さんの脳・脊髄の解剖で見られていましたが、これまでその原因や意義は不明でした。
この研究により、コネキシン蛋白の機能を修飾することで、これまでになかった二次進行形多発性硬化症の新規治療薬が開発できる可能性が高くなりました。既に同研究グループではコネキシン機能を修飾するいくつかの薬剤の効果がこのマウスモデルを使ってみられています。
本研究成果は、2020年 1月13日(月)付で米国科学アカデミー紀要(PNAS)に掲載されました。
本研究は、AMEDの課題番号JP19ek0109308h0002の支援を受けました。
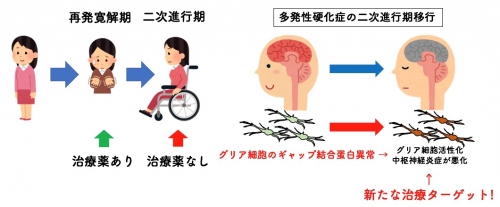
(参考図)二次進行型多発性硬化症の新たに発見された機序
中枢神経のグリア細胞(オリゴデンドログリア)のコネキシン蛋白の機能を阻害すると、アストログリアやミクログリアの炎症性活性化を介して末梢血からの白血球侵入を誘発し、さらに中枢神経の炎症が増幅される。
研究者からひとこと
この結果をもとに、従来治療法のなかった二次進行型多発性硬化症の新しい治療薬が開発できつつあります。できるだけ早く多発性硬化症の患者さんの治療に役立てたいと考えています。
- 本研究についての詳細は こちら
論文情報
Oligodendroglial connexin 47 regulates neuroinflammation upon autoimmune demyelination in a novel mouse model of multiple sclerosis ,PNAS,10.1073/pnas.1901294117