-
カテゴリ別
-
場所
-
最新のお知らせ 年間スケジュール(就職対策講座等) OB・OG情報 システムの利用方法 学内合同企業説明会(「九州大学生のための業界・企業研究」) 学内企業研究セミナー / 個別企業説明会 公務員・教員等採用情報 就職相談 就職情報室 キャリア教育 低年次学年向け情報 インターンシップ等(学生向け) TOEIC対策プログラム 博士人材のための就職支援(学生向け) 外国人留学生のための就職支援 未内定の学生及び既卒者(卒業後3年以内)の皆様へ 障害のある学生のための就職支援 部局独自の就職支援 東京・大阪・博多駅オフィスの利用 各種情報サイト 過去の就職状況 採用選考に関する指針 学内合同企業説明会 博士人材のための企業説明会(企業向け) 本学へのご訪問 求人情報ご提供 OB・OG名簿ご提供 インターンシップ等(企業向け) 外国人留学生の採用 採用選考に関する指針 就職担当 よくあるご質問
Research Results 研究成果
過酸化水素分解酵素カタラーゼが活性酸素などのストレス毒性を防御する事を発見 − 細胞小器官ペルオキシソームの新規生理的機能の解明に期待 −
2017.02.08研究成果Life & Health
九州大学生体防御医学研究所の藤木幸夫特任教授、ニューヨーク市スローンケタリングがんセンターのEmily Cheng教授らの研究グループは、過酸化水素分解酵素として知られるカタラーゼが細胞小器官ペルオキシソーム内から細胞質(サイトゾル)へ放出される現象を世界で初めて発見し、新たな酸化ストレス応答反応として機能することを明らかにしました。
ヒトをはじめ高等生物の細胞内では、膜構造で仕切られた細胞小器官(オルガネラ)が非常に発達しています。ペルオキシソームは、種々の酸化酵素ならびにそれら酸化反応に伴って生成する過酸化酸素を代謝(消去)するカタラーゼ等、多くの重要な酵素群を含む生命維持に必須の細胞小器官です。藤木らの研究グループは、これまでに哺乳動物のペルオキシソーム形成に必要なペルオキシン(PEX)遺伝子を数多くクローニングしており、これらがヒトにおける致死性の遺伝病であるペルオキシソーム欠損症の病因遺伝子であることも明らかにしてきました。今回、本研究グループは、カタラーゼのペルオキシソームへの輸送に異常を持つ新たな動物培養細胞変異株を用いてその原因遺伝子の探索を行い、驚くべきことにミトコンドリア外膜タンパク質(ポリン)遺伝子VDAC2を同定しました(図1)。結果として、VDAC2を受容体としてミトコンドリアに輸送され、細胞死(アポトーシス)の促進因子の一つとして働くBAKが、VDAC2欠損によりペルオキシソームにも一部局在化し、カタラーゼのペルオキシソームからサイトゾルへの放出を介在することを発見しました(図2)。さらに、広く知られたミトコンドリアでのBAKによる細胞死亢進とは逆に、ペルオキシソーム局在性BAKの活性化は、カタラーゼの放出を介して抗酸化ストレス反応として作用するという世界で初めての細胞死制御機構を明らかにしました。
今後は、このカタラーゼ放出機構を解明することにより、細胞死や神経変性等におけるペルオキシソームの生理的機能・重要性が明らかになるものと期待されます。
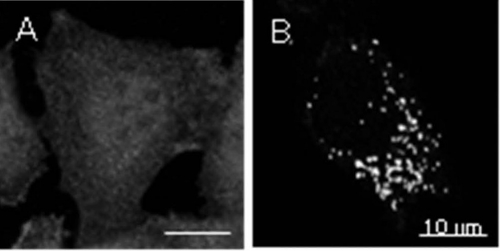
図1. カタラーゼ輸送障害性CHO細胞ZP114の原因遺伝子はVDAC2である。(A) ZP114細胞中のカタラーゼは細胞全体に散在している。(B) ZP114細胞にVDAC2遺伝子を導入すると、カタラーゼのペルオキシソーム(顆粒状構造)への輸送が回復する。
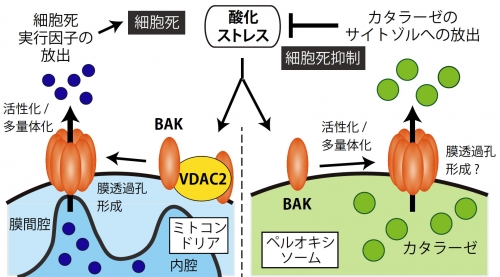
図2. カタラーゼのサイトゾル放出による新規ストレス応答機構酸化ストレスによりペルオキシソームに一部局在化するBAKが活性化される。ペルオキシソーム内の過酸化水素分解酵素カタラーゼがペルオキシソームからサイトゾルへ移行することで、酸化ストレス抵抗性および抗細胞死作用を呈する(右)。左は、VDAC2と共にミトコンドリア上で細胞死促進因子として働くBAKを示す。
- 本研究についての詳細は こちら
論文情報
The VDAC2–BAK axis regulates peroxisomal membrane permeability ,Journal of Cell Biology,10.1083/jcb.201605002