-
カテゴリ別
-
場所
-
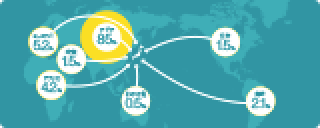
最新のお知らせ 年間スケジュール(就職対策講座等) OB・OG情報 システムの利用方法 学内合同企業説明会(「九州大学生のための業界・企業研究」) 学内企業研究セミナー / 個別企業説明会 公務員・教員等採用情報 就職相談 就職情報室 キャリア教育 低年次学年向け情報 インターンシップ等(学生向け) TOEIC対策プログラム 博士人材のための就職支援(学生向け) 外国人留学生のための就職支援 未内定の学生及び既卒者(卒業後3年以内)の皆様へ 障害のある学生のための就職支援 部局独自の就職支援 東京・大阪・博多駅オフィスの利用 各種情報サイト 過去の就職状況 採用選考に関する指針 学内合同企業説明会 博士人材のための企業説明会(企業向け) 本学へのご訪問 求人情報ご提供 OB・OG名簿ご提供 インターンシップ等(企業向け) 外国人留学生の採用 採用選考に関する指針 就職担当 よくあるご質問
Notices お知らせ
国内初の造血器腫瘍遺伝子パネル検査「ヘムサイト®」の製造販売承認取得について
2024.09.24お知らせ
大塚製薬株式会社(本社:東京都、以下「大塚製薬」)と国立研究開発法人国立がん研究センター(所在地:東京都、以下「国立がん研究センター」)が共同設計し、国立大学法人九州大学、国立がん研究センター、国立大学法人京都大学(所在地:京都府)、国立病院機構名古屋医療センター(所在地:愛知県)、国立大学法人東京大学医科学研究所 附属先端医療研究センター(所在地:東京都)、慶應義塾大学医学部(所在地:東京都)との共同研究コンソーシアムにて開発した造血器腫瘍遺伝子パネル検査「ヘムサイト®」について、大塚製薬が国内における製造販売承認を取得しましたので、お知らせします。今後、保険適用の手続きを行い、発売に向けた準備を進めます。
がん遺伝子パネル検査は、固形腫瘍を対象としたものが既に保険適用されていますが、造血器腫瘍では、製造販売承認されたものはなく、保険診療下でのがんゲノム医療が実施できておりません。本製品は、厚生労働省から先駆け審査指定制度の対象品目に指定され、国内で初めて製造販売承認された造血器腫瘍及び類縁疾患を対象とした遺伝子パネル検査です。体外診断用医薬品「ヘムサイト®診断薬」と医療機器プログラム「ヘムサイト®解析プログラム」により構成されています。
近年、世界保健機関(World Health Organization:WHO)等が提唱する造血器腫瘍の診断・治療指針では、ゲノム情報に基づいた診療が推奨され、ゲノム情報を用いずに適切な診断・治療を行うことが困難になりつつあります。国内においても、日本血液学会から造血器腫瘍ゲノム検査ガイドラインが発行され、白血病、悪性リンパ腫、多発性骨髄腫など疾患・ステージ毎に遺伝子パネル検査推奨度が提示されています。本製品は、同ガイドラインにある造血器腫瘍の遺伝子異常が網羅的に検査できるように設計されており、遺伝子異常による「診断」、「治療法選択」、「予後予測」が可能になることが期待されます。
このたびの造血器腫瘍遺伝子パネル検査「ヘムサイト®」の承認により、日本国内における造血器腫瘍領域において、個別化医療が大きく進歩し、よりよい医療に貢献することが期待されます。
- 本件の詳細についてはこちら